Brasil se torna o primeiro país a adotar a tafenoquina em dose única e o teste STANDARD™ G6PD para o tratamento de recaídas da malária por Plasmodium Vivax
- Mais de 80% dos 139.021 casos de malária registrados em 2021 foram causados por P. vivax.
- O teste rápido e o medicamento de dose única ajudarão a atingir a meta de eliminação da malária no Brasil, melhorando a adesão do paciente e garantindo sua segurança.
Brasília/Genebra/Seattle – 6 de junho 2023. A Medicines for Malaria Venture (MMV) e a PATH anunciam hoje que o Brasil se tornou o primeiro país com malária endêmica a incorporar o teste STANDARD™ G6PD e a tafenoquina em dose[1] única no Sistema Único de Saúde para o tratamento do Plasmodium vivax (P. vivax malária). Estas inovadoras tecnologias de saúde fornecem cura radical simples e eficaz, prevenindo a recaída da maláriapor P. vivax.
“Estamos entusiasmados com a decisão do governo brasileiro”, celebrou o Dr. David Reddy, CEO da MMV. “O Brasil desempenhou um papel fundamental nos estudos de eficácia e segurança que levaram à aprovação da tafenoquina em dose única para prevenção de recaída do P. vivax e à primeira implementação no mundo real de testes de G6PD e tafenoquina. É muito bom ver o país liderando o caminho na avaliação e adoção dessas novas tecnologias de saúde”.
“A implementação da tafenoquina e do teste de diagnóstico G6PD nacionalmente e sua integração ao protocolo de tratamento do paciente podem levar a uma vida mais saudável. Agradecemos todas as contribuições do Ministério da Saúde, pesquisadores e trabalhadores da malária no Amazonas e Rondônia que tornaram este momento possível”, comenta Kammerle Schneider, Diretora de Programas e Inovação, PATH.
A decisão de adotar as ferramentas foi baseada em uma avaliação de evidências realizada pela Comissão Brasileira de Incorporação de Tecnologias no Sistema Único de Saúde (CONITEC) a pedido do Programa de Malária do Ministério da Saúde. Esta avaliação, incluiu 1) evidências sobre segurança e eficácia e resultados da primeira e segunda análises interinas do TRuST – o maior estudo de campo sobre o uso de tafenoquina de dose única e testes de G6PD no mundo, realizado nos municípios de Manaus e Porto Velho, Brasil entre 2021 e 2022 -, 2) um estudo qualitativo ligado ao TRuST sobre as percepções de pacientes e profissionais de saúde em relação ao teste de G6PD e tafenoquina de dose única, 3) uma análise de custo-efetividade e uma análise de impacto orçamentário.
O estudo TRuST foi co-patrocinado pelo Ministério da Saúde e pela MMV e liderado por Dr. Marcus Lacerda, da Fundação de Medicina Tropical Dr. Heitor Vieira Dourado (FMT-HVD), e pelo Dr. Dhelio Pereira, do Centro de Pesquisa em Medicina Tropical de Rondônia (CEPEM) nos municípios de Manaus (AM) e Porto Velho (RO) respectivamente.
“O Programa Nacional de Malária do Brasil está atualmente focado na eliminação da malária, uma meta ambiciosa para a qual a inovação é fundamental. A incorporação desta inovação ao Sistema Único de Saúde possibilitará aos pacientes com malária vivax um tratamento mais seguro e de menor duração, beneficiando especialmente a população que vive em áreas remotas da região amazônica”, afirmou Ethel Maciel, secretária de Vigilância em Saúde e Ambiente do Ministério da Saúde.
Estima-se que a malária por P. vivax cause entre 4,5 e 5,5 milhões de infecções clínicas todo ano. [2] Os sintomas da doença incluem febre, calafrios, vômitos, mal-estar, dor de cabeça e dor muscular e, em alguns casos, podem levar à malária grave e à morte. [3] A doença tem considerável impacto econômico e social, perpetuando ciclos de pobreza. Um dos principais desafios para o controle da malária no Brasil é a baixa adesão ao tratamento, levando a recaídas e transmissão contínua. O acesso a populações remotas, como comunidades indígenas, é outro grande desafio. A simplicidade dessas novas ferramentas ajudará a meta de eliminação da malária no Brasil, melhorando a adesão ao tratamento.
Sobre a malária por P. vivax
A malária P. vivax tem um impacto econômico e de saúde pública significativo, principalmente no Sul da Ásia, Sudeste Asiático, América Latina e Chifre da África. O parasita Plasmodium é um organismo complexo, com um ciclo de vida que abrange humanos e mosquitos[4]. Após a picada de um inseto infectado, o P. vivax se espalha pelo sangue e causa um episódio agudo de malária. Ele também tem a capacidade de ficar dormente no fígado (em uma forma conhecida como hipnozoíto), de onde reativa periodicamente para causar recaídas da doença. Assim, uma única infecção de P. vivax pode dar origem a múltiplos episódios de malária, mesmo na ausência de uma nova picada de mosquito. Essas recaídas podem ocorrer semanas, meses ou até anos após a infecção inicial. As formas hepáticas dormentes do parasita não podem ser tratadas com a maioria dos medicamentos antimaláricos, que atuam contra o parasita apenas em seu estágio sanguíneo.
A coadministração de um antimalárico em estágio sanguíneo, como a cloroquina, e um medicamento que tem como alvo as formas hepáticas dormentes do parasita é conhecida como cura radical.
Sobre a tafenoquina
A tafenoquina, desenvolvida pela GSK e MMV, foi aprovada pela primeira vez em julho de 2018 pela Food and Drug Administration (FDA) dos EUA para a cura radical (prevenção de recaída) da malária P. vivax. O medicamento deve ser usado em combinação com a cloroquina e era destinado a adultos e adolescentes maiores de 16 anos. Posteriormente, a tafenoquina foi aprovada para esta mesma faixa etária por agências reguladoras da Austrália, Brasil, Tailândia, Peru, Colômbia e Filipinas. No entanto, a Australian Therapeutic Good Administration (TGA) expandiu o uso para abranger crianças a partir de dois anos e pesando pelo menos 10 kg. Aprovações similares encontram-se pendentes de revisão em países endêmicos.
Aplicações regulatórias estão sendo desenvolvidas em outros países com malária endêmica. Todas as aprovações são baseadas em dados de eficácia e segurança de um programa global de desenvolvimento clínico para a cura radical do P. vivax, conduzido em nove países endêmicos. Os resultados da avaliação benefício-risco para uso do produto foram positivos.
A tafenoquina deve ser coadministrada com cloroquina para tratar os estágios sanguíneo e hepático das infecções agudas por malária P. vivax (conhecida como cura radical). Antes de tomar tafenoquina, os infectados devem ser testados para determinar seu status em relação a uma enzima conhecida como glicose-6-fosfato desidrogenase (G6PD), que ajuda a proteger os glóbulos vermelhos. Os pacientes com deficiência de G6PD podem ter reações adversas graves, como hemólise, durante o tratamento com a classe de medicamentos 8-aminoquinolina (como tafenoquina e primaquina). Dessa forma, apenas os infectados com atividade enzimática da G6PD acima de 70% devem receber tafenoquina.
Sobre o teste STANDARD™ G6PD
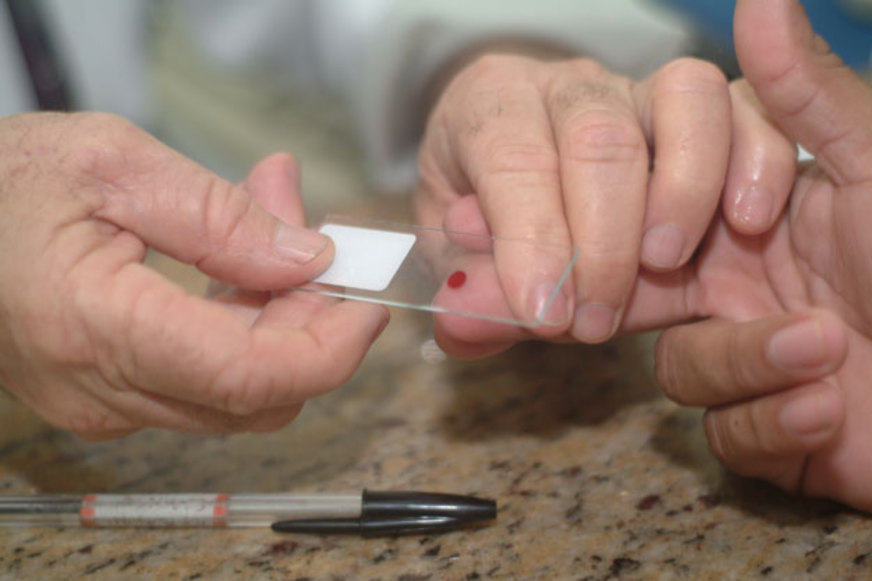
O teste STANDARD™ G6PD, fabricado pela SD Biosensor, é um novo teste semiquantitativo para deficiência de G6PD destinado ao uso no local do atendimento. O teste usa um analisador portátil alimentado por bateria que mede a atividade da G6PD e os níveis de hemoglobina e fornece uma medida numérica da atividade da G6PD normalizada pela hemoglobina (U/g Hb). Esse valor pode, então, ser usado de forma semiquantitativa para classificar o indivíduo com deficiência de G6PD, intermediário ou normal, de acordo com os limiares fornecidos pelo fabricante.
Atualmente, é o único teste quantitativo de G6PD disponível comercialmente para apoiar a introdução e o uso da tafenoquina, e é distribuído em mais de 30 países.
A Organização Mundial da Saúde (OMS) recomenda a realização de um teste de G6PD antes do tratamento com primaquina. Até recentemente, os únicos testes confiáveis para deficiência de G6PD eram limitados a diagnósticos baseados em laboratório que exigem experiência, tempo e recursos significativos para serem executados. O teste STANDARD G6PD fornece o resultado em menos de dois minutos a um profissional de saúde, informando-o se um paciente que apresenta infecção por P. vivax tem atividade suficiente de G6PD em suas hemácias para ser tratado com um medicamento 8-aminoquinolina. A introdução desse teste possibilita o uso da tafenoquina – que só é indicada para pacientes com atividade enzimática da G6PD >70%, que é considerado como atividade normal – em locais onde as pessoas procuram atendimento primário de saúde, inclusive em unidades básicas de saúde em locais remotos, como a Amazônia brasileira.
Sobre o TRuST
O Tafenoquine Roll-oUt Study (TRuST) foi o primeiro estudo observacional de mundo real a avaliar a viabilidade de fornecer tratamento contra a recaída com tafenoquina ou primaquina com base nos resultados do teste G6PD. O estudo, co-patrocinado pelo Ministério da Saúde e a Medicines for Malaria Venture (MMV), foi liderado pelo Dr. Marcus Lacerda e Dr. Dhelio Pereira. A Global Health Strategies (GHS) América Latina têm desempenhado um papel fundamental no apoio à equipe do TRuST.
O estudo foi implementado em fases. A primeira fase teve início em setembro de 2021 e foi realizada em nove unidades de saúde de nível superior e médio em Manaus e Porto Velho, na região Amazônica. Em fevereiro de 2022, o estudo foi ampliado para 40 unidades de atenção básica nos mesmos municípios. As inclusão de dados de pacientes no banco de dados do estudo terminou em agosto de 2022 e, em dezembro de 2022, um dossiê abrangente elaborado em parceria com o consórcio PAVE foi enviado pelo Programa de Malária do Ministério da Saúde à CONITEC solicitando a incorporação da tafenoquina de dose única e do teste STANDARDTM G6PD ao Sistema Único de Saúde (SUS).
Sobre a PATH
A PATH é uma organização global que trabalha para acelerar a equidade em saúde, reunindo instituições públicas, empresas, empreendimentos sociais e investidores para resolver os desafios de saúde mais urgentes do mundo. Nossa equipe de inovadores é composta por mais de 1.600 funcionários em escritórios de 21 países. Com experiência em ciência, saúde, economia, tecnologia, advocacia e dezenas de outras especialidades, a PATH desenvolve e dimensiona soluções, incluindo vacinas, medicamentos, dispositivos, diagnósticos e abordagens inovadoras para fortalecer os sistemas de saúde em todo o mundo. Trabalhamos em mais de 70 países para transformar ideias ousadas em soluções sustentáveis que melhorem a saúde e o bem-estar de todos, alcançando, em média, mais de 150 milhões de pessoas a cada ano.
Sobre a Medicines for Malaria Venture (MMV)
A MMV é uma parceria de desenvolvimento de produtos (PDP) líder no campo da pesquisa e desenvolvimento de medicamentos antimaláricos. Sua missão é reduzir a carga da malária em países endêmicos; descobrindo, desenvolvendo e facilitando a entrega de medicamentos antimaláricos novos, eficazes e acessíveis.
A MMV recebe financiamento e apoio de agências governamentais, fundações privadas, organizações internacionais, corporações, fundações empresariais e pessoas físicas. Esses fundos são usados para financiar o portfólio de projetos de pesquisa e desenvolvimento da MMV, bem como intervenções específicas e direcionadas de acesso e gerenciamento de produtos (APM). Essas ações visam facilitar o aumento do acesso a medicamentos contra a malária por populações vulneráveis em países endêmicos e apoiar seu uso apropriado.
A MMV gerencia um portfólio de mais de 65 medicamentos antimaláricos – o maior já montado. Com parceiros, eles apresentaram 15 medicamentos que estão sendo usados para tratar pacientes. Esses medicamentos salvaram mais de 3 milhões de vidas. Para mais informações, visite o Link.
Sobre o PAVE
PAVE é a Parceria para a Eliminação do Vivax liderada pela MMV e PATH, que reúne Programas Nacionais de Malária, pesquisadores, financiadores e outras organizações para eliminar a maláriaP. vivax.
O PAVE ajuda os países a atingirem seus objetivos de eliminação através de:
- Coordenação com os Programas Nacionais de Malária para identificar opções e estratégias ideais de ferramentas de cura radical para seus contextos específicos, a fim de alcançar uma cobertura mais ampla de pacientes.
- Geração e disponibilização de evidências de alta qualidade sobre o gerenciamento de casos de P. vivax que possam ser consideradas pelos governos nacionais na tomada de decisões políticas e na orientação da implementação.
- Avanços no desenvolvimento de medicamentos e diagnósticos para P. vivax. de qualidade assegurada.